người ta điều chế sắt từ oxit sắt từ Fe3O4 theo sơ đồ CO+Fe3O4 - - - -> Fe+CO2 a, nếu dùng 1 tấn quặng chứa 90% là Fe3O4 thì lượng sắt kim loại thu được là bao nhiêu kg? b, muốn được 1 tấn sắt thì phải dùng bao nhiêu tấn quặng nói trên?

Những câu hỏi liên quan
người ta điều chế sắt từ oxit sắt từ Fe3O4 theo sơ đồ
CO+Fe3O4 - - - -> Fe+CO2
a, nếu dùng 1 tấn quặng chứa 90% là Fe3O4 thì lượng sắt kim loại thu được là bao nhiêu kg?
b, muốn được 1 tấn sắt thì phải dùng bao nhiêu tấn quặng nói trên?
a) PTHH:
Fe3O4 + 4CO =(nhiệt)=> 3Fe + 4CO2
1 (mol)------------------------3 (mol)
232(kg)----------------------168(kg)
900 (kg)----------------------x (kg)
Ta có: Khối lượng Fe3O4 có trong 1 tân quặng là: mFe3O4 = 1 x 90% = 0.9 (tấn ) = 900 (kg)
Lập các tỉ lệ số mol và khối lượng theo phương trình ( x là khối lượng kim loại sắt thu được )
=> x = \(\frac{900\times168}{232}\approx651,72\left(kg\right)\)
b)PTHH:
Fe3O4 + 4CO =(nhiệt)=> 3Fe + 4CO2
1 (mol)----------------------3(mol)
232 (tấn)---------------------168 (tấn)
y (tấn)--------------------------1 (tấn)
Lập các số mol và khối lượng trên phương trình ( y là khối lượng Fe3O4 cần dùng )
=> y = \(\frac{1\times232}{168}=1,4\left(t\text{ấn}\right)\)
=> Khối lượng quặng cần dùng: mquặng = \(1,4\div\frac{90}{100}=1,556\left(t\text{ấn}\right)\)
Đúng 0
Bình luận (1)
A là một loại quặng sắt chứa 60% Fe2O3; B là loại quặng sắt khác chứa 69,6% Fe3O4. Hỏi trong một tấn quặng A hoặc B có chứa bao nhiêu kg sắt? 2. Trộn quặng A với quặng B theo tỉ lệ khối lượng mA:mB = 2:5 ta được quặng C có bao nhiêu kg sắt
M là một quặng sắt chứa 60% Fe2O3, N là một quặng sắt khác chứa 69,6% Fe3O4 trộn quặng M với N theo tỉ lệ khối lượng mM : mN = 2 : 5 ta được quặng C. Hỏi 1 tấn quặng C chứa bao nhiêu kg sắt
Ta có: \(\dfrac{m_M}{m_N}=\dfrac{2}{5}\Rightarrow5m_M-2m_N=0\left(1\right)\)
Mà: mM + mN = 1 (tấn) = 1000 (kg) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}m_M=\dfrac{2000}{7}\left(kg\right)\\m_N=\dfrac{5000}{7}\left(kg\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe_2O_3}=m_M.60\%=\dfrac{1200}{7}\left(kg\right)\Rightarrow n_{Fe_2O_3}=\dfrac{\dfrac{1200}{7}}{160}=\dfrac{15}{14}\left(kmol\right)\)
\(\Rightarrow n_{Fe}=2n_{Fe_2O_3}=\dfrac{15}{7}\left(kmol\right)\)
\(m_{Fe_3O_4}=m_N.69,6\%=\dfrac{3480}{7}\left(kg\right)\Rightarrow n_{Fe_3O_4}=\dfrac{\dfrac{3480}{7}}{232}=\dfrac{15}{7}\left(kmol\right)\)
\(\Rightarrow n_{Fe}=3n_{Fe_3O_4}=\dfrac{45}{7}\left(kmol\right)\)
\(\Rightarrow m_{Fe}=\left(\dfrac{15}{7}+\dfrac{45}{7}\right).56=480\left(kg\right)\)
Đúng 1
Bình luận (0)
M là một quặng sắt chứa 60% Fe2O3, N là một quặng sắt khác chứa 69,6% Fe3O4 trộn quặng M với N theo tỉ lệ khối lượng mM : mN = 2 : 5 ta được quặng C. Hỏi 1 tấn quặng C chứa bao nhiêu kg sắt
Bạn xem lời giải ở đây nhé.
https://olm.vn/hoi-dap/detail/7712766586263.html
Đúng 0
Bình luận (0)
X là quặng hematit chứa 60% Fe2O3, Y là quặng manhetit chứa 69,6% Fe3O4.
a, Từ 1 tấn quặng X hoặc Y điều chế được tối đa bao nhiêu kg sắt kim loại?
b, Cần trộn X và Y theo tỉ lệ khối lượng là bao nhiêu để được quặng Z mà từ 1 tấn Z có thể điều chế được 05 tấn gang chứa 4% cacbon.
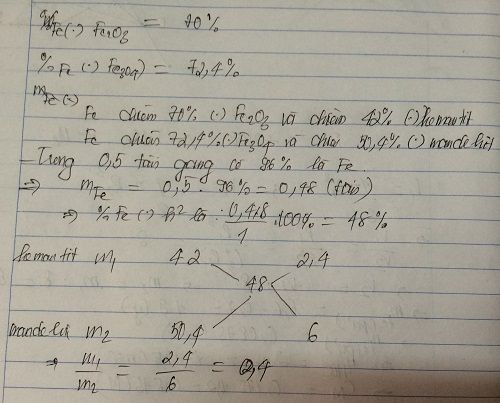
đề sai sai nha !
X là quặng hematit chứa 60% Fe2O3, Y là quặng manhetit chứa 69,6% Fe3O4. Cần trộn X, Y theo tỉ lệ khối lượng như thế nào để được quặng Z mà từ 1 tấn quặng Z có thể điều chế được 0,5 tấn gang chứa 96% sắt?OK!
Đúng 0
Bình luận (0)
Có thể điều chế được bao nhiêu kg sắt từ 1 tấn quặng có chứa 90% sắt từ oxit FeO4.
Biết lượng sắt bị hao hụt là 4%
Cho Fe=56 /O=16
Quặng oxit sắt từ ( Fe 3 O 4 ) chứa 64,15% sắt. Hãy tính lượng gang sản xuất được từ 1 tấn quặng nói trên. Biết rằng, trong lò cao có 2% sắt bị mất theo xỉ và lượng sắt có trong gang là 95%.
Khối lượng Fe có trong quặng: 1x64,15/100 = 0,6415 tấn
Khối lượng Fe có trong gang: 0,6415 x (100-2)/100 = 0,62867 tấn
Khối lượng gang sản xuất được: 0,62867 x 100/95 ≈ 0,662 tấn
Đúng 0
Bình luận (0)
a) A là một loại quặng chứa 60% Fe2O3; B là một loại quặng khác chứa 69,6% Fe3O4. Hỏi trong 1 tấn quặng nào chứa nhiều sắt hơn? là bao nhiêu kg?
b) Trộn quặng A với quặng B theo tỉ lệ khối lượng là mA:mB=2:5 ta được quặng C. Hỏi trong 1 tấn quặng C có bao nhiêu kg Sắt
%mFe ( trong A ) =
=> mFe ( trong A ) =
Vậy trong 1 tấn quặng A có chứa 420 kg Fe
%mFe ( trong B ) =
=> mFe ( trong B ) =
Vậy trong 1 tấn quặng B có chứa 504 kg Fe
%mFe2O3 =
%mFe3O4 =
=> mFe( quặng A trong C ) =
mFe ( quặng B trong C ) =
=> mFe ( trong C ) = 126 + 352,8 = 478,8 (kg)
Đúng 3
Bình luận (3)
1 một kim loại X chứa 64% Fe2O3, quặng Y chứa 69,6% Fe3O4. Trộn a tấn quặng X với b tấn quặng Y thu được một loại quặng Z có thể điều chế được 481,25 kg gang chứa 4% cacbon.( Gang là hợp chất của sắt và cacbon).2 Phân hủy hoàn toàn một hợp chất A ở nhiệt độ cao theo phương trình sau: 4A nhiệt phân------ 4B+ C + 2DCác sản phẩm tạo thành đều ở thể khí. Tính tỉ khối của hỗn hợp khí sau phản ứng so với khí hidro là 18. Xác định khối lượng mol của chất A C...
Đọc tiếp
1> một kim loại X chứa 64% Fe2O3, quặng Y chứa 69,6% Fe3O4. Trộn a tấn quặng X với b tấn quặng Y thu được một loại quặng Z có thể điều chế được 481,25 kg gang chứa 4% cacbon.( Gang là hợp chất của sắt và cacbon).
2> Phân hủy hoàn toàn một hợp chất A ở nhiệt độ cao theo phương trình sau:
4A nhiệt phân------> 4B+ C + 2D
Các sản phẩm tạo thành đều ở thể khí. Tính tỉ khối của hỗn hợp khí sau phản ứng so với khí hidro là 18. Xác định khối lượng mol của chất A
Các bạn giúp tui nha cám ơn mn nhiều:))
2)
Giả sử có 1 mol A
PTHH: 4A --to--> 4B + C + 2D
1------->1-->0,25->0,5
=> nkhí sau pư = 1 + 0,25 + 0,5 = 1,75 (mol)
BTKL: mA = mB + mC + mD
Có \(\overline{M}=\dfrac{m_B+m_C+m_D}{1,75}=18.2=36\)
=> mA = 63 (g)
=> \(M_A=\dfrac{63}{1}=63\left(g/mol\right)\)
Đúng 3
Bình luận (0)
câu 1) đề có nói rõ điều chế 481,25kg gang từ bao nhiêu Z không vậy bn :) ?
Đúng 1
Bình luận (3)
1)
Giả sử a + b = 1 (tấn)
Do cacbon chiếm 4%
=> Fe chiếm 96% khối lượng gang
\(m_{Fe}=\dfrac{481,25.10^3.96}{100}=462.10^3\left(g\right)\)
=> \(n_{Fe}=\dfrac{462.10^3}{56}=8,25.10^3\left(mol\right)\)
\(m_{Fe_2O_3\left(X\right)}=\dfrac{a.10^6.64}{100}=640.10^3.a\left(g\right)\)
=> \(n_{Fe_2O_3}=\dfrac{640.10^3.a}{160}=4.10^3.a\left(mol\right)\)
\(m_{Fe_3O_4\left(Y\right)}=\dfrac{b.10^6.69,6}{100}=696.10^3.b\left(g\right)\)
=> \(n_{Fe_3O_4}=\dfrac{696.10^3.b}{232}=3.10^3.b\left(mol\right)\)
Bảo toàn Fe:
2.4.103.a + 3.3.103.b = 8,25.103
=> 8a + 9b = 8,25
Mà a + b = 1
=> a = 0,75; b = 0,25
=> \(\dfrac{a}{b}=\dfrac{0,75}{0,25}=\dfrac{3}{1}\)
Đúng 1
Bình luận (0)



















